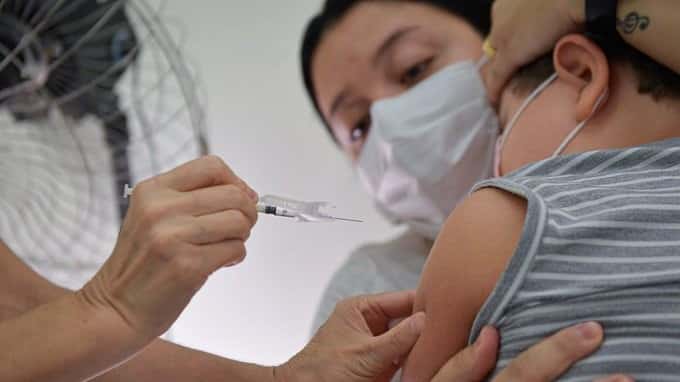
La Administración de Drogas y Alimentos de Estados Unidos (FDA) autorizó el uso de emergencia de la vacuna contra el COVID-19 de Moderna y de Pfizer-BioNTech para su uso en niños de hasta 6 meses de edad. Para la vacuna de Moderna, la FDA modificó la autorización de uso de emergencia para personas de 6 meses y hasta los 17 años de edad. La vacuna había sido autorizada para su uso en adultos mayores de 18 años.
Para la vacuna Pfizer-BioNTech, la FDA modificó el uso para incluir a personas de 6 meses a 4 años de edad. La vacuna había sido autorizada para su uso en personas de 5 años de edad y mayores.
La evaluación y el análisis de la FDA sobre la seguridad, la eficacia y los datos de fabricación de estas vacunas fueron rigurosos y completos.
La agencia determinó que los beneficios conocidos y potenciales de las vacunas Moderna y Pfizer-BioNTech superan los riesgos conocidos y potenciales en las poblaciones pediátricas autorizadas para el uso de cada vacuna.
Antes de tomar la decisión de autorizar estas vacunas para las respectivas poblaciones, se consultó al Comité Asesor de Vacunas y Productos Biológicos Relacionados de la FDA, que votó a favor de las autorizaciones.
Today, we authorized emergency use of the Moderna COVID-19 Vaccine and the Pfizer-BioNTech COVID-19 Vaccine for the prevention of COVID-19 to include use in children down to 6 months of age. https://t.co/DFnvVyQ8n6 pic.twitter.com/mXuN3oqZaa
— U.S. FDA (@US_FDA) June 17, 2022
For the Pfizer-BioNTech COVID-19 Vaccine, we amended the EUA to include use of the vaccine in individuals 6 months through 4 years of age. The vaccine had been authorized for use in individuals 5 years of age and older.
— U.S. FDA (@US_FDA) June 17, 2022